


تاریخچه
اصول طیف سنجی جرمی ، جلوتر از هر یک از تکنیکهای دستگاهی دیگر ، بنا نهاده شده است. تاریخ پایه گذاری اصول اساسی آن به سال 1898 بر میگردد. در سال 1911 ، "تامسون" برای تشریح وجود نئون-22 در نمونهای از نئون-20 از طیف جرمی استفاده نمود و ثابت کرد که عناصر میتوانند ایزوتوپ داشته باشند. تا جایی که میدانیم، قدیمیترین طیف سنج جرمی در سال 1918 ساخته شد.
اما روش طیف سنجی جرمی تا همین اواخر که دستگاههای دقیق ارزانی در دسترس قرار گرفتند، هنوز مورد استفاده چندانی نداشت. این تکنیک با پیدایش دستگاههای تجاری که بسادگی تعمیر و نگهداری میشوند و با توجه به مناسب بودن قیمت آنها برای بیشتر آزمایشگاههای صنعتی و آموزشی و نیز بالا بودن قدرت تجزیه و تفکیک ، در مطالعه تعیین ساختمان ترکیبات از اهمیت بسیاری برخوردار گشته است.
اصول طیف سنجی جرمی 
به بیان ساده ، طیف سنج جرمی سه عمل اساسی را انجام میدهد:
مولکولها توسط جرایاناتی از الکترونهای پرانرژی بمباران شده و بعضی از مولکولها به یونهای مربوطه تبدیل میگردند. سپس یونها در یک میدان الکتریکی شتاب داده میشوند.
یونهای شتاب داده شده بسته به نسبت بار/جرم آنها در یک میدان مغناطیسی یا الکتریکی جدا میگردند.
یونهای دارای نسبت بار/جرم مشخص و معین توسط بخشی از دستگاه که در اثر برخورد یونها به آن ، قادر به شمارش آنها است، آشکار میگردند. نتایج داده شده خروجی توسط آشکار کننده بزرگ شده و به ثبات داده میشوند. علامت یا نقشی که از ثبات حاصل میگردد یک طیف جرمی است، نموداری از تعداد ذرات آشکار شده بر حسب تابعی از نسبت بار/جرم.
دستگاه طیف سنج جرمی
هنگامی که هر یک از عملیات را بدقت مورد بررسی قرار دهیم، خواهیم دید که طیف سنج جرمی واقعا پیچیدهتر از آن چیزی است که در بالا شرح داده شد.
سیستم ورودی نمونه
قبل از تشکیل یونها باید راهی پیدا کرد تا بتوان جریانی از مولکولها را به محفظه یونیزاسیون که عمل یونیزه شدن در آن انجام میگیرد، روانه ساخت. یک سیستم ورودی نمونه برای ایجاد چنین جریانی از مولکولها بکار برده میشود. نمونههایی که با طیف سنجی جرمی مورد مطالعه قرار میگیرند، میتوانند به حالت گاز ، مایع یا جامد باشند. در این روش باید از وسایلی استفاده کرد تا مقدار کافی از نمونه را به حالت بخار در آورده ، سپس جریانی از مولکولها روانه محفظه یونیزاسیون شوند.
در مورد گازها ، ماده ، خود به حالت بخار وجود دارد. پس ، از سیستم ورودی سادهای میتوان استفاده کرد. این سیستم تحت خلاء بوده، بطوری که محفظه یونیزاسیون در فشاری پایینتر از سیستم ورودی نمونه قرار دارد.
روزنه مولکولی
نمونه به انبار بزرگتری رفته که از آن ، مولکولهای بخار به محفظه یونیزاسیون میروند. برای اطمینان از اینکه جریان یکنواختی از مولکولها به محفظه یونیزاسیون وارد میشود، قبل از ورود ، بخار از میان سوراخ کوچکی که "روزنه مولکولی" خوانده میشود، عبور میکند. همین سیستم برای مایعات و جامدات فرار نیز بکار برده میشود. برای مواد با فراریت کم ، میتوان سیستم را به گونهای طراحی کرد که در یک اجاق یا تنور قرار گیرد تا در اثر گرم کردن نمونه ، فشار بخار بیشتری حاصل گردد. باید مراقب بود که حرارت زیاد باعث تخریب ماده نگردد.
در مورد مواد جامد نسبتا غیر فرار ، روش مستقیمی را میتوان بکار برد. نمونه در نوک میلهای قرار داده میشود و سپس از یک شیر خلاء ، وارد محفظه یونیزاسیون میگردد. نمونه در فاصله بسیار نزدیکی از پرتو یونیزه کننده الکترونها قرار میگیرد. سپس آن میله ، گرم شده و تولید بخاری از نمونه را کرده تا در مجاورت پرتو الکترونها بیرون رانده شوند. چنین سیستمی را میتوان برای مطالعه نمونهای از مولکولهایی که فشار بخار آنها در درجه حرارت اتاق کمتر از 9 - 10 میلیمتر جیوه است، بکار برد.
محفظه یونیزاسیون
هنگامی که جریان مولکولهای نمونه وارد محفظه یونیزاسیون گشت ، توسط پرتوی از الکترونهای پرانرژی بمباران میشود. در این فرآیند ، مولکولها به یونهای مربوطه تبدیل گشته و سپس در یک میدان الکتریکی شتاب داده میشوند. در محفظه یونیزاسیون پرتو الکترونهای پرانرژی از یک "سیم باریک" گرم شده ساطع میشوند. این سیم باریک تا چند هزار درجه سلسیوس گرم میشود. به هنگام کار در شرایطی معمولی ، الکترونها دارای انرژی معادل 70 میکرون - ولت هستند.
این الکترونهای پرانرژی با مولکولهایی که از سیستم نمونه وارد شدهاند، برخورد کرده و با برداشتن الکترون از آن مولکولها ، آنها را یونیزه کرده و به یونهای مثبت تبدیل میکنند. یک "صفحه دافع" که پتانسیل الکتریکی مثبتی دارد، یونهای جدید را به طرف دستهای از "صفحات شتاب دهنده" هدایت میکند. اختلاف پتانسیل زیادی (حدود 1 تا 10 کیلو ولت) از این صفحات شتاب دهنده عبور داده میشود که این عمل ، پرتوی از یونهای مثبت سریع را تولید میکند. این یونها توسط یک یا چند "شکاف متمرکز کننده" به طرف یک پرتو یکنواخت هدایت میشوند.
بسیاری از مولکولهای نمونه به هیچ وجه یونیزه نمیشوند. این مولکولها بطور مداوم توسط مکندهها یا پمپهای خلا که به محفظه یونیزاسیون متصل نیستند، خارج میگردند. بعضی از این مولکولها از طریق جذب الکترون به یونهای منفی تبدیل میشوند. این یونهای منفی توسط صفحه دافع جذب میگردند. ممکن است که بخش کوچکی از یونهای تشکیل شده بیش از یک بار داشته باشند، (از دست دادن بیش از یک الکترون) اینها مانند یونهای مثبت تک ظرفیتی ، شتاب داده میشوند.
پتانسیل یونیزاسیون
انرژی لازم برای برداشتن یک الکترون از یک اتم یا مولکول ، پتانسیل یونیزاسیون آن است. بسیاری از ترکیبات آلی دارای پتانسیل یونیزاسیونی بین 8 تا 15 الکترون ولت هستند. اما اگر پرتو الکترونهایی که به مولکولها برخورد میکند، پتانسیلی معادل 50 تا 70 الکترون ولت نداشته باشد، قادر به ایجاد یونهای زیادی نخواهد بود. برای ایجاد یک طیف جرمی ، الکترونهایی با این میزان انرژی برای یونیزه کردن نمونه بکار برده میشوند.
تجزیه گر جرمی
پس از گذر کردن از محفظه یونیزاسیون ، پرتو یونها از درون یک ناحیه کوتاه فاقد میدان عبور میکند. سپس آن پرتو ، وارد "تجزیه گر جرمی" شده که در آنجا ، یونها بر حسب نسبت بار/جرم آنها جدا میشوند. انرژی جنبشی یک یون شتاب داده شده برابر است با:
12mv2=ev
که m جرم یون ، v سرعت یون ، e بار یون و V اختلاف پتانسیل صفحات شتاب دهنده یون است.
در حضور یک میدان مغناطیسی ، یک ذره باردار مسیر منحنی شکلی را خواهد داشت. معادلهای که شعاع این مسیر منحنی شکل را نشان میدهد به صورت زیر است:
(r =MV)/eH
که r شعاع انحنای مسیر و H قدرت میدان مغناطیسی است.
اگر این دو معادله را برای حذف عبارت سرعت ترکیب کنیم، خواهیم داشت:
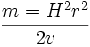
این معادله مهمی است که رفتار و عمل یک یون را در بخش تجزیهگر جرمی یک طیف سنج جرمی توجیه میکند.
طیف سنج جرمی
تجزیه گر جرمی و قدرت تفکیک 
از معادله فوق چنین بر میآید که هر قدر ، مقدار m/e بزرگتر باشد، شعاع انحنای مسیر نیز بزرگتر خواهد بود. لوله تجزیهگر دستگاه طوری ساخته شده است که دارای شعاع انحنای ثابتی است. ذرهای که نسبت m/e صحیحی داشته باشد، قادر خواهد بود تا طول لوله تجزیهگر منحنی شکل را طی کرده ، به آشکار کننده نمیرسند. مسلما اگر دستگاه ، یونهایی را که جرم بخصوصی دارند، نشان دهد. این روش چندان جالب نخواهد بود.
بنابراین بطور مداوم ، ولتاژ شتاب دهنده یا قدرت میدان مغناطیسی تغییر یافته تا بتوان کلیه یونهایی که در محفظه یونیزاسیون تولید گشتهاند را آشکار ساخت. اثری که از آشکار کننده حاصل میگردد، بصورت طرحی است که تعداد یونها را بر حسب مقدار m/e آنها رسم میکند. فاکتور مهمی که باید در یک طیف سنج جرمی در نظر گرفتن قدرت تفکیک آن است. قدرت تفکیک بر طبق رابطه زیر تعریف میشود:
(R=M)/M
که R قدرت تفکیک ، M جرم ذره و M∆ اختلاف جرم بین یک ذره با جرم M و ذره بعدی با جرم بیشتر است که میتواند توسط دستگاه تفکیک گردد. دستگاههایی که قدرت تفکیک ضعیفی دارند، مقدار R آنها حداکثر 2000 در بعضی مواقع قدرت تفکیکی به میزان پنج تا ده برابر مقدار فوق مورد نیاز است.
آشکار کننده
آشکار کننده بسیاری از دستگاهها ، شامل یک شمارشگر است که جریان تولیدی آن متناسب با تعداد یونهایی است که به آن برخورد میکند. با استفاده از مدارهای الکترون افزاینده میتوان آن قدر دقیق این جریان را اندازه گرفت که جریان حاصل از برخورد فقط یک یون به آشکار کننده اندازه گیری شود.
ثبات آشکار کننده
سیگنال تولید شده از آشکار کننده به یک ثبات داده میشود که این ثبات خود طیف جرمی را ایجاد مینماید. در دستگاههای جدید ، خروجی آشکار کننده از طریق یک سطح مشترک به رایانه متصل است. رایانه قادر به ذخیره اطلاعات بوده و خروجی را به هر دو صورت جدولی و گرافیکی در میآورد. دست آخر دادهها با طیفهای استاندارد ذخیره شده موجود در رایانه مقایسه میگردد.
در دستگاهها قدیمیتر ، جریان الکترونی حاصل از آشکار کننده به یک سری از پنج گالوانومتر با حساسیتهای متفاوت داده میشود. پرتو نوری که به آینههای متصل به گالوانومترها برخورد میکند و به یک صفحه حساس به نور منعکس میگردد. بدین طریق یک طیف جرمی با پنج نقش بطور همزمان ، هر یک با حساسیتی متفاوت ایجاد میگردد. در حالی که هنوز دستگاه قویترین قلهها را در صفحه طیف نگاه میدارد، با استفاده از این پنج نقش ثبت ضعیفترین قلهها نیز ممکن میگردد.
اشعه کاتدی: ذرات الکترونی پر انرژی هستند که از کاتد حرارت دیده ساطع میشوند.
از اشعه های یون زا برای استریل کردن وسائل و بسته های پلاستیکی مثل سرنگ ها و بوات های یکبار مصرف استفاده میشود.
شناخت اشعه کاتدی
طی آزمایشاتی که بر روی الکترولیز توسط فاراده Faraday انجام شد وی دو قانون معروف خود را به شرح زیر در سال ۱۸۳۰ میلادی منتشر نمود:
۱- در الکترولیز مقدار عنصر آزاد شده متناسب با مقدار جریان الکتریسته است.به عنوان مثال اگر ۱ فاراد یا ۹۶۵۰۰ کولن الکتریسته را ازمحلول نمک حاوی یون تک ظرفیتی جیوه عبور دهیم، ۱ مول اتم جیوه و اگر از محلول نمک حاوی یون دو ظرفیتی عبور دهیم ۰.۵ مول اتم جیوه ته نشین می شود. پس بسته هایی از الکتریسته وجود دارد که یک بسته از آن ها به سمت فلز تک ظرفیتی و دو بسته به سمت فلز دو ظرفیتی حرکت می کنند.
۲- هرگاه مقدار یکسان جریان الکتریسیته را از سه ظرف بگذرانیم که حاوی نمک ها با ظرفیت های متفاوت هستند، یعنی در ظرف اول نمک یک ظرفیتی، در ظرف دوم نمک دو ظرفیتی و در ظرف سوم نمک سه ظرفیتی داشته باشیم. رسوبهای فلز حاصل از عبور جریان الکتریسیته از ظروف متناسب با جرم اتمی فلز تقسیم بر ظرفیت عناصر آن می باشد.
نتیجه: هر اتم مقداری ثابت بار می گیرد. اتم یک ظرفیتی یک بسته، اتم دو ظرفیتی دو بسته و اتم سه ظرفیتی سه بسته بار می تواند حمل نماید.و هرگز جزء کسری از بار الکتریکی مانند ۱.۲۳ را به خود نمی گیرند. این بسته برای تمام اتمها یکسان است، یعنی الکتریسته از بسته ها یا ذرات کوچکی تشکیل شده اند. که آنها را الکترون می گوییم.
بعد از آزمایش الکترولیز بر روی مایعات و جامدات نوبت به الکترولیز گازها رسید که در الکترولیز گازها نتایج زیر به دست آمد:
۱- ولتاژ معمولی از گازها عبور نمی کند.
۲- در ولتاژهای بالا چنانچه فاصله دو الکترود زیاد باشد جریان الکتریسیته عبور نمی کند.
۳- در فشار معمولی به ازای هر سانتیمتر فاصله الکترودها به ۳۰۰۰۰ ولت اختلاف پتانسیل نیازمندیم.
در جریان این آزمایش ها دانشمندان مجبور به ساختن لوله هایی از جنس شیشه شدند تا بتوانند فشار داخل آن را کاهش داده و به بررسی های
۱- در فشار 0.1 اتمسفر اگر ولتاژ ۱۰۰۰۰ ولت برقرار شود، گاز درون لوله ملتهب شده و به رنگ های گوناگون پرتو افشانی می نماید. به عنوان مثال نئون رنگ قرمز، هوا رنگ صورتی ملایم، بخار سدیم رنگ زرد و بخار جیوه رنگ آبی مایل به سبز را ایجاد می نماید.
 ۲- در فشار کمتر از 0.0001 اتمسفر و ولتاژ بالای ۱۰۰۰۰ ولت جداره شیشه ملتهب شده و نور سبز مغز پسته از خود منتشر می نماید.
۲- در فشار کمتر از 0.0001 اتمسفر و ولتاژ بالای ۱۰۰۰۰ ولت جداره شیشه ملتهب شده و نور سبز مغز پسته از خود منتشر می نماید.
۳- با کم کردن فشار تا 0.000001 اتمسفر روشنایی از بین رفته و نوعی درخشندگی یا تابش مهتابی در دیواره لوله ایجاد می شود که در حضور صفحات فلوئور به طور کامل قابل مشاهده است.
این اشعه که توسط ویلیام کروکس William Crookes کشف گردید به اشعه کاتدی معروف شد. اشعه کاتدی نیز به نوبه خود مورد مطالعه قرار
۱- برای اینکه ماهیت این اشعه هرچه بیشتر برای ما روشن گردد یک مانع بین دو الکترود در لوله قرار می دهیم.
همانطور که مشاهده می شود ، در سمت آند سایه ای تشکیل می شود و این بدان معناست که اشعه از کاتد خارج شده و به سمت آند حرکت می کند. همچنین می توان نتیجه گرفت که این اشعه به خط مستقیم سیر می کند.
۲- جابجایی کاتد در لوله تأثیری در جهت اشعه نداشته و اشعه به خط مستقیم سیر می نماید.

به محل قرار گرفتن آند توجه کنید.
۳- جنس کاتد را تغییر می دهیم ولی در اشعه هیچ تغییری مشاهداه نمی شود. بنابراین ماهیت اشعه به جنس کاتد بستگی ندارد و تمام فلزات توان تولید این اشعه را دارند. 
۴- جنس گاز داخل لوله را تغییر می دهیم ولی باز در ماهیت اشعه تغییری مشاهده نمی شود. بنابراین ماهیت اشعه به جنس گاز داخل لوله بستگی ندارد.
۵- یک فرفره پره دار را در مسیر اشعه قرار می دهیم.
مشاهده می شود که مدتی پس از شروع به کار دستگاه فرفره شروع به حرکت می نماید. این مطلب نشان دهنده آن است که اشعه کاتدی حامل ذراتی است که دارای انرژی هستند. این ذرات پس از برخورد با پره های فرفره انرژی خود را به پره ها می دهند به همین دلیل پره ها گرم شده و باعث گرم شدن گاز اطراف خود می شوند. گاز گرم شده درون لوله توسط جریان همرفتی به حرکت درآمده و باعث چرخش فرفره می گردد.
۶- یک میدان الکتریکی قوی را از خارج لوله بر اشعه اثر می دهیم.

همانطور که مشاهده می شود، اشعه در میدان الکتریکی به سمت قطب مثبت منحرف می شود. یعنی اینکه دارای بار منفی است.
۷- از خارج از لوله یک میدان مغناطیسی را بر اشعه اثر می دهیم.

اشعه در راستای عمود بر میدان در جهتی منحرف می شود که از بار ذرات دارای بار منفی انتظار می رود. بنابراین اشعه از جنس ذرات باردارمی باشد.
بنابراین با توجه به آزمایشات فوق داریم:
۱- اشعه کاتدی از ذراتی که دارای بار منفی هستند تشکیل شده است. این ذرات را در سال ۱۸۷۴ الکترین نامیدند که در سال ۱۸۹۱ بعد از آزمایشات فوق این نام به الکترون تغییریافت.
۲- این اشعه به نوع فلز کاتد یا گاز داخل لوله بشتگی نداردُ بنابراین تمام مواد دارای الکترون هستند. 
بعدها از اشعه کاتدی در ساخت تلویزیون ها و مانیتورها استفاده شد، ساخت این تجهیزات شاید بدون اشعه کاتدی میسر نمی شد. به صفحه نمایش مانیتورها و تلویزیون هایی با استفاده از اشعه کاتدی تصویر را ایجاد می نمایند بطور اختصاری CRT گفته می شود که مخفف Cathode Ray Tube می باشد. در شکل نحوه عملکرد این نمایشگرها را می بینید.
با توجه به اینکه آزمایشات فوق نشان دهنده وجود ذره ای کوچکتر از اتم با بار منفی هستند، بنابراین نظریه اتمی دالتون به چالش بزرگی کشانده شده است، اما در علم برای اثبات وجود یک ذره باید مختصات آن ذره یعنی جرم و مقدار بار آن تعیین گردد.
در سال 1920 رادرفورد اظهار داشت که پروتون درون هسته ممکن است دارای یک الکترون باشد  .در چنین صورتی این الکترون چنان محکم به آن بسته شده است که یک ذره ی خنثی ایجاد کرده است. رادرفورد حتی برای این ذرهی فرضی نام نوترون (به معنای خنثی) راپیشنهاد کرد . تحقیق در یافتن نوترون تا سال 1932 به دو دلیل نامؤفق ماند .اول آنکه دانشمندان نمی توانستند ماده ی طبیعی بیابند که گسیل کننده ی نوترون باشد و دیگر آنکه روش هایی که برای آشکارسازی ذرات اتمی به کار برده می شد ، همگی به آثار بار الکتریکی ذرات بستگی داشت.
.در چنین صورتی این الکترون چنان محکم به آن بسته شده است که یک ذره ی خنثی ایجاد کرده است. رادرفورد حتی برای این ذرهی فرضی نام نوترون (به معنای خنثی) راپیشنهاد کرد . تحقیق در یافتن نوترون تا سال 1932 به دو دلیل نامؤفق ماند .اول آنکه دانشمندان نمی توانستند ماده ی طبیعی بیابند که گسیل کننده ی نوترون باشد و دیگر آنکه روش هایی که برای آشکارسازی ذرات اتمی به کار برده می شد ، همگی به آثار بار الکتریکی ذرات بستگی داشت.
در سال 1930 بث و بکر دریافتند که وقتی نمونه هایی از بور یا بریلیم با ذرات آلفا بمباران شوند، تابش هایی از آنها گسیل می شود که در آن وقت به نظر می رسید که از نوع پرتوهای گاما هستند زیرا این پرتوها فاقد بار الکتریکی بودند . فردریک ژولیو و ایرن کوری به بررسی جذب تابش مذکور در پارافین پرداختند(پارافین ماده ی غنی از هیدروژن است) . آنها دریافتند که تابش حاصل ا زبریلیم وقتی به پارافین برخورد می کند، تعداد بسیاری هسته ی هیدروژن (پروتون) از پارافین می راند .چادویک به مطالعه ی انرژی پروتون های رانده شده پرداخت و بر اساس قوانین پایستگی و اندازه حرکت در فیزیک کلاسیک ، این فرض را بنا نهاد که ماهیت تابش حاصل از بمباران بریلیم نوترونی است که بار صفر و جرم برابر یک دارد . به عبارت دیگر وقتی بریلیم با ذره ی آلفا بمباران شود ، واکنش هسته ای صورت می گیرد و نوترون تولید میشود:

وقتی نوترون ها به درون پارافین راه می یابند، گاه و بی گاه با هسته های هیدروژن برخوردهای رودرو پیدا می کنند و به دلیل یونشی که ایجاد می کنند پروتون هایی پس زده مشاهده می شود . چنین نوترون هایی بنا به فرض چادویک به علت آنکه بار الکتریکی ندارند می توانند در اجزای ماده ی متراکمی همچون سرب نفوذ کنند بدون آنکه انرژی خود را از دست بدهند .
از سال 1932 به بعد درباره ی خواص و برهم کنش بین نوترون ها و اتم ها پژوهش های بسیاری به عمل آمده و شاخه ای به نام فیزیک نوترونی بوجود آمد . فیزیک نوترونی با تولید نوترون ها ، آشکارسازی آنها و برهم کنش آنها با هسته های اتمی و با ماده ی توده ای سروکار دارد .این پژوهش ها در میان پژوهش های دیگر به کشف شکافت هسته ای انجامید .
در آزمایش تامسون از اثر میدان الکتریکی و میدان مغناطیسی استفاده شده است. دستگاهی که در این آزمایش مورد استفاده قرار گرفته است از قسمتهای زیر تشکیل شده است:
الف ) اطاق یونش که در حقیقت چشمه تهیه الکترون با سرعت معین می باشد بین کاتد و آند قرار گرفته است. در این قسمت در اثر تخلیه الکتریکی درون گاز ذرات کاتدی ( الکترون ) بوجود آمده بطرف قطب مثبت حرکت می کنند و با سرعت معینی از منفذی که روی آند تعبیه شده گذشته وارد قسمت دوم می شود. اگر بار الکتریکی q تحت تاثیر یک میدان الکتریکی بشدت E قرار گیرد، نیروییکه از طرف میدان بر این بار الکتریکی وارد می شود برابر است با:
F= q.E
در آزمایش تامسون چون ذرات الکترون می باشند q = -e بنابراین:
F= -eE
از طرف دیگر چون شدت میدان E در جهت پتانسیلهای نزولی یعنی از قطب مثبت بطرف قطب منفی است بنابراین جهت نیرویF در خلاف جهت یعنی از قطب منفی بطرف قطب مثبت می باشد. اگرx فاصله بین آند و کاتد باشد کار نیروی F در این فاصله برابر است با تغییرات انرژی جنبشی ذرات . از آنجاییکه کار انجام شده در این فاصله برابراست با مقدار بار ذره در اختلاف پتانسیل موجود بین کاتد وآند بنابراین خواهیم داشت :
ev0 =½m0v2
که در آن v0 اختلاف پتانسیل بین کاتد و آند e بار الکترون v سرعت الکترون و m0 جرم آن می باشد. بدیهی است اگر v0 زیاد نباشد یعنی تا حدود هزار ولت رابطه فوق صدق می کند یعنی سرعت الکترون مقداری خواهد بود که می توان از تغییرات جرم آن صرفنظ نمود . بنابراین سرعت الکترون در لحظه عبور از آند بسمت قسمت دوم دستگاه برابر است با:
v = √(2e v0/ m0)
ب) قسمت دوم دستگاه که پرتو الکترونی با سرعت v وارد آن می شود شامل قسمتهای زیر است :

1- یک خازن مسطح که از دو جوشن A وB تشکیل شده است اختلاف پتانسیل بین دو جوشن حدود دویست تا سیصد ولت می باشد اگر پتانسیل بین دو جوشن را به v1 و فاصله دو جوشن را به d نمایش دهیم شدت میدان الکتریکی درون این خازن E = v1/d خواهد بود که در جهت پتانسیلهای نزولی است.
2- یک آهنربا که در دو طرف حباب شیشه ای قرار گرفته و در داخل دو جوشن خازن: یک میدان مغناطیسی با شدت B ایجاد می نماید . آهنربا را طوری قرار دهید که میدان مغناطیسی حاصل بر امتداد ox امتداد سرعت - و امتداد oy امتداد میدان الکتریکی - عمود باشد.
پ) قسمت سوم دستگاه سطح درونی آن به روی سولفید آغشته شده که محل برخورد الکترونها را مشخص می کند.
وقتی الکترو از آند گذشت و وارد قسمت دوم شد اگر دو میدان الکتریکی و مغناطیسی تاثیر ننمایند نیرویی بر آنها وارد نمی شود لذا مسیر ذرات یعنی پرتو الکترونی مستقیم و در امتداد ox امتداد سرعت ) خواهد بود و در مرکز پرده حساس p یعنی نقطه p0 اثر نورانی ظاهر می سازد.
اگر بین دو جوشن خازن اختلاف پتانسیلv1 را برقرار کنیم شدت میدان الکتریکی دارای مقدار معین E خواهد بود و نیروی وارد از طرف چنین میدانی بر الکترون برابر است با FE = e E این نیرو در امتداد oy و در خلاف جهت میدان یعنی از بالا به پایین است.

میدان مغناطیسی B را طوری قرار می دهند که برسرعتv عمود باشد . الکترون در عین حال در میدان مغناطیسی هم قرار می گیرد و نیرویی از طرف این میدان بر آن وارد می شود که عمود بر سرعت و بر میدان خواهد بود . اگر این نیرو را بصورت حاصلضرب برداری نشان دهیم برابر است با:
FM = q.(VXB)
در اینجا q = e پس:
FM = q.(VXB)
و مقدار عددی این نیرو مساوی است با F = e v B زیرا میدان B بر سرعت v عمود است یعنی زاویه بین آنها 90 درجه و سینوس آن برابر واحد است. اگر میدان B عمود بر صفحه تصویر و جهت آن بجلوی صفحه تصویر باشد امتداد و جهت نیروی FM در جهت oy یعنی در خلاف جهت FE خواهد بود. حال میدان مغناطیسی B را طوری تنظیم می نمایند کهFE = FM گردد و این دو نیرو همدیگر را خنثی نمایند. این حالت وقتی دست می دهد که اثر پرتو الکترونی روی پرده بی تغییر بماند پس در این صورت خواهیم داشت:
FM = FE
e.v.B = e E
v = E/ B
چون مقدار E و B معلوم است لذا از این رابطه مقدار سرعت الکترون در لحظه ورودی به خازن بدست می اید . حال که سرعت الکترون بدست آمد میدان مغناطیسی B را حذف می کنیم تا میدان الکتریکی به تنهای بر الکترون تاثیر نماید . از آنجاییکه در جهت ox نیرویی بر الکترون وارد نمی شود و فقط نیروی FE بطور دائم آنرا بطرف پایین می کشد لذا حرکت الکترون در داخل خازن مشابه حرکت پرتابی یک گلوله در امتداد افقی می باشد و چون سرعت الکترون را نسبتا کوچک در نظر می گیریم معادلات حرکت الکترون ( پرتو الکترونی ) در دو جهت ox و oy معادلات دیفرانسیل بوده و عبارت خواهد بود از :
m0(d2x /dt2)=0 در امتداox
m0(d2y /dt2)=e. E در امتداoy
با توجه به اینکه مبدا حرکت را نقطه ورود به خازن فرض می کنیم اگر از معادلات فوق انتگرال بگیریم خواهیم داشت:
y=(1/2)(e.E)t2/m0
x=v.t
معادلات فوق نشان می دهد که مسیر حرکت یک سهمی است و مقدار انحراف پرتو الکترونی از امتداد اولیه (ox ) در نقطه خروج از خازن مقدار y در این لحظه خواهد بود . اگرطول خازن را به L نمایش دهیم x = L زمان لازم برای سیدن به انتهای خازن عبارت خواهد بود از t = L / v اگر این مقدار t را در معادله y قرار دهیم مقدار انحراف در لحظه خروج از خازن به دست می آید:
Y = ½ e( E/m0) ( L/ v )2
e/ m0 = ( 2y/ E ) ( v/ L )2
که در آن v سرعت الکترون که قبلا بدست آمده است. L و E بترتیب طول خازن و شدت میدان الکتریکی که هر دو معلوم است پس اگر مقدار y را اندازه بگیریم بار ویژه یا e/m0 محاسبه می شود.
پس از خروج الکترون از خازن دیگر هیچ نیرویی بر آن وارد نمی شود بنابراین از آن لحظه به بعد حرکت ذره مستقیم الخط خواهد بود و مسیر آن مماس بر سهمی در نقطه خروج از خازن است . اگر a فاصله پرده از خازن یعنی D P0 باشد می توانیم بنویسیم:
P0P1 = y + DP0 tgθ
tgθعبارتست از ضریب زاویه مماس بر منحنی مسیر در نقطه خروج از خازن و بنابراین مقدار یست معلوم پس باید با اندازه گرفتن فاصله اثر روی پرده( P0 P1)به مقدار y رسید و در نتیجه می توانیم e/ m0 را محاسبه نماییم.
مقداری که در آزمایشات اولیه بدست آمده بود 108×7/1 کولن بر گرم بود مقداریکه امروزه مورد قبول است و دقیقتر از مقدار قبلی است برابر 108×7589/1 کولن بر گرم است.
علاوه بر تامسون، میلیکان نیز از سال 1906 تا 1913 به مدت هفت سال با روشی متفاوت به اندازه گیری بار الکترون پرداخت.
جوزف جان تامسون در هجده دسامبر سال 1856 در شهر منچستر انگلستان به دنیا آمد وسر انجام در سال 1940 در انگلستان چشم به جهان فرو بست .
پدرش به جمع آوری کتاب ها علاقه داشت ولی تامسون علاقه ی خود را متوجه معلمی کرد ، به طوری که هشت نفر از شاگردانش برنده جایزه علمی نوبل شدند . او که در نزدیکی منچستر به دنیا آمده بود ، در سن 14 سا لگی به کا لج اونس که امروز دانشگاه ویکتوریا نامیده می شود ، راه یافت . جوزف در کا لج از کمک هزینه تحصیلی استفاده می کرد و شاید اگر این کمک هرینه نبود ، جوزف بعد از فوت پدرش نمی توانست ادامه تحصیل بدهد .
تامسون در نوزده سالگی فارغ التحصیل رشته مهندسی شد و در امتحان دانشگاه کمبریج شرکت کرد و رتبه دوم را حائز شد و در این دانشگاه نیز با استفاده از کمک هزینه تحصیلی
به تحصیل پرداخت و در رشته فیزیک فارغ التحصیل گردید . او پس از فراغت از تحصیل رسمی به استخدام کا لج تری نیتی همین دانشگاه کمبریج در آمد و در آزمایشگاه کاوندیش به تحقیق پرداخت . در سال 1884 لرد رایلی که رئیس آزمایشگاه بود استعفاکرد و تامسون که فقط 28 سال از سنش می گذشت به ریاست آزمایشگاه انتخاب شد . گرچه کمی سن او مخالفت بسیاری از استادان را برانگیخت و لیکن نبوغ تامسون و حسن مدیریت او سبب شد که مدت 34 سال این آزمایشگاه را با سطح بالای تحقیق علمی جهان اداره کند . او نه تنها مدیر ان آزمایشگاه تحقیقاتی بود ، بلکه خود نیز در شمار محققین ممتاز این مرکز بود .
از آثار علمی او
در سال 1897 تامسون به نام « پدر الکترون » شهرت یافت . او که بر روی اشعه ی کاتدیک مطالعه می کرد با مشاهده انحراف این اشعه در میدان های مغناطیسی و الکتریکی عتقد شد که این اشعه ، جریانی از ذره های باردار الکتریکی منفی هستند . تامسون جرم نسبی هر ذره را به دست آورد مشخص کرد که جرم هر الکترون تقریبا یک دو هزارم جرم ئیدروژن است .
به تشویق تامسون ، ویلسون یکی از شاگردان ، « اتاق ابری » ساخت و با آن برای تعیین و تشخیص ذرات اتمی استفاده کرد . از جمله ویلسون توانست جرم و مقدار بار الکترون را اندازه گیری کند .
تامسون پس از 37 سال مدیریت آزمایشگاه کاوندیش ، استعفا کرد و شاگردش ارنست رادرفورد به ریاست آزمایشگاه انتخاب شد.
تامسون در آخر عمر روحیه ای پر نشاط داشت . موفقیت خود و پسر و شاگردش ارنست رادرفورد سهم عمده ای در نشاط او داشتند